来源:广西肝脏疾病免疫与代谢研究重点实验室 发布时间:2025-12-08 作者:姚美 校对:韦载娲 审核:钟伏弟 浏览量:次
![]()
肝脏的病理状态,特别是恶性肿瘤的发展,与肿瘤微环境内复杂的代谢重编程密不可分。2025年10月,一项发表在《Nature Metabolism》,首次系统揭示了肿瘤相关巨噬细胞(Tumor-Associated Macrophages,TAMs)通过一条全新的代谢轴,充当乙酸盐供体,从而驱动肝细胞癌 (hepatocellular carcinoma,HCC)转移的详细机制。

HCC的转移是一个复杂的过程,其关键代谢特征之一是癌细胞需要维持高水平的乙酰辅酶A(acetyl-CoA)以支持其迁移和侵袭能力。癌细胞通常通过摄取乙酸盐来合成acetyl-CoA,但肿瘤微环境中乙酸盐的具体来源尚不清楚。本研究旨在探索HCC微环境中乙酸盐积累的调控机制,并确定其在转移中的作用。
2. “乳酸-脂质过氧化-ALDH2”轴是TAMs生产乙酸盐的核心机制
本研究发现的代谢互作通路:(1)启动信号:肝癌细胞分泌乳酸。(2)TAMs响应:乳酸激活TAMs内的活性氧水平和脂质过氧化过程。(3)乙酸盐生成:脂质过氧化产生的醛类物质(如乙醛)被乙醛脱氢酶2(Aldehyde Dehydrogenase 2,ALDH2)代谢,最终转化为乙酸盐并分泌。抑制该通路的任何环节(ALDH2或脂质过氧化),均能阻断TAMs的乙酸盐生产及其促癌迁移能力。
3. TAMs来源的乙酸盐通过表观遗传重编程促进HCC转移
TAMs分泌的乙酸盐被肝癌细胞摄取后,经acetyl-CoA合成酶 1或 acetyl-CoA合成酶2转化为acetyl-CoA。这增加了组蛋白H3的乙酰化水平,进而促进上皮-间质转化相关基因(如TWIST、N-钙黏蛋白)的表达,最终增强肝癌细胞的迁移和侵袭能力。
4. 靶向该代谢轴可有效抑制HCC转移
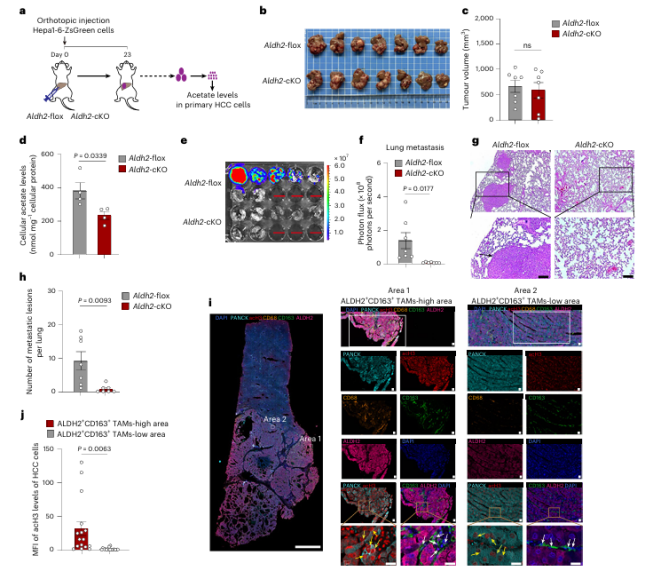
在动物模型中,TAMs特异性敲除ALDH2基因,或使用ALDH2抑制剂,可显著降低肝癌细胞内的乙酸盐水平,并大幅减少肺转移灶的数量,而不影响原发性肿瘤的生长。这证实了靶向该通路在抑制HCC转移方面的治疗潜力。
5. 机制的普适性与临床意义
上述促转移机制并非HCC特有,具有普遍性。本研究发现TAMs的培养上清同样能提升乳腺癌、胰腺癌和结肠癌细胞的组蛋白乙酰化水平,提示这一代谢共生模式可能广泛存在于多种实体瘤中。此外,对HCC患者组织的分析显示,在 ALDH2高表达的TAMs密集浸润的区域,其周边的癌细胞也呈现出更高的组蛋白H3乙酰化 水平。这种特定的肿瘤微环境特征,与患者更差的临床预后趋势相关,进一步验证了该通路在人类癌症进展中的重要作用。
1. 重新定义TAMs的角色:将TAMs从传统的“免疫调节者”和“生长因子提供者”,提升为关键的“代谢供体”。它们通过代谢重编程,为癌细胞提供必需的燃料,直接驱动其恶性行为。
2. 揭示完整的肿瘤代谢共生新范式:研究首次系统阐明了 “癌细胞(乳酸)→ TAMs(脂质过氧化/ALDH2)→ 乙酸盐 → 癌细胞(acetyl-CoA/表观遗传)” 这一完整的代谢耦合回路。这为理解肿瘤微环境中细胞间代谢互作提供了全新框架。
3. 提出“一箭双雕”的治疗新思路:靶向该通路中的关键节点(如ALDH2、脂质过氧化或acetyl-CoA合成酶 1 / acetyl-CoA合成酶2),有望同时破坏癌细胞的能量/表观遗传燃料供应和TAMs的促转移功能,为开发抗肿瘤转移疗法提供了极具潜力的新靶点。
本研究深刻揭示了肿瘤微环境中免疫细胞与癌细胞之间复杂的代谢共生关系,为通过干预代谢互作来阻断癌症转移开辟了新的理论和治疗方向。
所有版权@广西肝脏疾病免疫与代谢研究重点实验室 ICP备案号: 桂ICP备05004851号-3
所有版权@广西肝脏疾病免疫与代谢研究重点实验室 ICP备案号: 桂ICP备05004851号-3